| Caso de hibridacion |
La hibridación de orbitales atómicos fue postulada por Pauling en el 1931 para poder explicar la geometría experimental determinada para algunas moléculas. Considera que los orbitales atómicos se pueden combinar entre ellos. Se obtienen tantos orbitales híbridos como orbitales atómicos se combinen (si se combinan 3 orbitales atómicos, se obtienen 3 orbitales híbridos).
Los orbitales que se combinan siempre deben de estar en la misma órbita o nivel de energía. En una molécula, los átomos terminales no presentan hibridación; en cambio, los átomos centrales (que se encuentran entre dos o más átomos), pueden presentar diferentes hibridaciones.
El proceso de hibridación consiste en la combinación de dos o más orbitales atómicos puros para obtener la misma cantidad de orbitales híbridos.
La hibridacion se da unicamente con elementos ubicados en la tabla periodica en el grupo 4 y 5; los elementos que pueden hibridarse son suministrados de luz o calor, producto del cual se salta el spin mas cerca al espacio vacio y se forma un nuevo orbital del mismo nivel y con la misma energia.
Las formas de las moléculas enlazadas por hibridaciones de sus orbitales es forzada por los ángulos entre sus átomos; encontramos 6 tipos:
- Sin hibridacion
- Hibridacion sp
- Hibridacion sp2
- Hibridacion sp3
- Hibridacion sp3d
- Hibridacion sp3d2
Un ejemplo claro puede ser, la hibridación del carbono la cual consiste en un reacomodo de electrones del mismo nivel de energía (orbital s) al orbital p del mismo nivel de energía. Esto es debido a que el carbono tiene un número atómico de 6 y número de masa de 12; en su núcleo tiene 6 protones y 6 neutrones y está rodeado por 6 electrones.
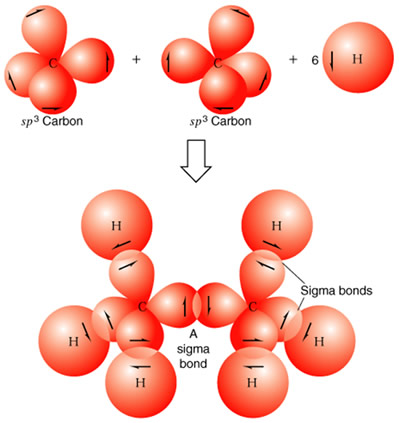 |
| Hibridacion del carbono |
Un orbital híbrido es conveniente para describrir la forma en que en la realidad se disponen los electrones para producir las propiedades que se observan en los enlaces atómicos.
Cabe destacar que el átomo que se hibrida es el átomo central. Los otros átomos enlazados a éste se enlazarán, generalmente, con su orbital atómico correspondiente sin hibridar, salvo en el caso de los enlaces carbono-carbono.
Así, en función de los orbitales atómicos que se combinen, tendremos distintos resultados con sus respectivas variantes, conformando finalmente la hibridacion correspondiente.
Creado y editado por:
Matthew Arroba
Alvaro Vallejo
Curso: 1° de Bachillerato "A"